El Manejo Reproductivo de las explotaciones ganaderas tiene por objeto lograr el mayor número de hembras preñadas en el momento biológicamente adecuado y económicamente rentable a cada uno de los sistemas de producción.
Teniendo en cuenta lo anterior es indispensable obtener los mejores índices de fertilidad de los animales involucrados en la reproducción como son novillas de vientre, hembras proximas, vacas postparto, vacas en producción, vacas secas, hembras gestantes, hembras vacías y reproductores o semen congelado en caso de IA. Los objetivos se fundamentan en el manejo de los ciclos reproductivos a través del conocimiento de la fisiología y comportamiento reproductivo de cada hembra en particular y del hato en general.
El manejo reproductivo excede lo estrictamente biológico e interactúa y se relaciona con la alimentación, genética, manejo, personal disponible, clima, sistema de producción, sanidad, bienestar animal, entre otros (CAVESTANY).
El primer paso al asumir la dirección o manejo profesional de un hato ganadero, es el de determinar cual es el estado productivo y reproductivo del mismo. En el aspecto reproductivo debe realizarse el examen ginecológico de las hembras aptas reproductivamente, así como el examen andrológico de los reproductores. Luego y de acuerdo a los resultados obtenidos se harán los lotes de producción tales como, terneraje de cría, machos y hembras de levante, novillas de vientre, vacas paridas, vacas en producción, vacas horras, machos de levante, machos de ceba, toretes, toros reproductores.
Teniendo en cuenta lo anterior es indispensable obtener los mejores índices de fertilidad de los animales involucrados en la reproducción como son novillas de vientre, hembras proximas, vacas postparto, vacas en producción, vacas secas, hembras gestantes, hembras vacías y reproductores o semen congelado en caso de IA. Los objetivos se fundamentan en el manejo de los ciclos reproductivos a través del conocimiento de la fisiología y comportamiento reproductivo de cada hembra en particular y del hato en general.
El manejo reproductivo excede lo estrictamente biológico e interactúa y se relaciona con la alimentación, genética, manejo, personal disponible, clima, sistema de producción, sanidad, bienestar animal, entre otros (CAVESTANY).
Todos estos factores deben ser analizados con el fin de lograr su adaptación al sistema de producción a implementar, por lo que la capacitación del personal que interviene en el mismo es fundamental. El papel del profesional es aplicar la tecnología disponible y articularla con el propietario, administrador, técnicos y personal de campo, para lograr este objetivo.
A manera de ejemplo, en el caso de una explotación de leche, para lograr una adecuada productividad es necesario mantener una proporción de un 80% de hembras lactando, un 20% seco y un 60% de hembras gestantes, durante todos los meses del año.
Dentro de los objetivos del manejo reproductivo del hato el más importante es lograr un parto cada 12 -12.5 meses y por lo tanto una cría y lactancia al año. Esto significa que debe quedar gestante dentro de los siguientes 90 a 105 días postparto; para alcanzar esta meta es fundamental el pronto reinicio de la actividad ovárica postparto, la adecuada involución uterina, una buena eficiencia en la detección de celos y alta fertilidad en cada servicio. Para asegurar que estos hechos ocurran dentro de tiempos y parámetros ideales, es necesario realizar un seguimiento de las vacas desde el parto hasta que quedan nuevamente gestantes. (HERNANDEZ)
PUNTOS A TENER EN CUENTA EN EL MANEJO REPRODUCTIVO
ATENCION AL PARTO.- Debe prestarse principal atención al aspecto sanitario, higiene y cuidados al nacimiento, con el fin de evitar en lo posible nacimientos de crías muertas, distocia infecciones y complicaciones puerperales (endometritis, retención de placenta), trastornos metabólicos (hipocalcemia, cetosis etc) que puedan influir negativamente en la salud del animal y demoren su reintegro a un nuevo ciclo reproductivo. Para ello se debe contar con un área especial o "paritorio " para las vacas próximas, con el fin de intervenir oportuna y de manera adecuada según el caso. Esta área debe estar alejada del área de tratamiento de animales con afecciones podales o del área de alojamiento de terneros.
REVISION OBLIGATORIA DE CADA VACA A LOS 30 DIAS POSTPARTO. En este período debe haberse efectuado normalmente la involución uterina y reiniciado la actividad ovárica. En este examen se determina la presencia o ausencia de estructuras ováricas o de patologías uterinas existentes, ya sea por palpación y/o por ecografia. De acuerdo a los resultados se instaurarán los protocolos de manejo y tratamiento establecidos.
VIGILANCIA DE LA ACTIVIDAD ESTRAL, con el fin de registrar los celos manifiestos en los primeros 50 días postparto. Los Días de Espera Voluntarios -DEV- son decisión del ganadero y/o del profesional. Las vacas que durante las 6-7 semanas no ha manifestado estro, serán apartadas a los 60 días postparto y examinadas ginecológicamente para determinar su estado reproductivo, presencia de patologías y evolución de la terapia administrada o recomendación de una nueva.
REVISION DE LAS HEMBRAS QUE PRESENTAN CELO A LOS 21 DIAS DEL SERVICIO. Estas hembras recibiran el tratamiento adecuado con el fin de evitar que se conviertan en vacas repetidoras.
DIAGNOSTICO DE GESTACION A LOS 45-60 DIAS DEL SERVICIO Y CONFIRMACION A LOS 90 DIAS.
Comprende el grupo de hembras que se encuentran dentro del PEV y que una vez confirmadas van a los potreros de vacas gestantes en ganado de carne, hasta dos meses antes del parto esperado.
Comprende el grupo de hembras que se encuentran dentro del PEV y que una vez confirmadas van a los potreros de vacas gestantes en ganado de carne, hasta dos meses antes del parto esperado.
CONFIRMACION DE GESTACION A LAS VACAS QUE ENTRAN A PERIODO DE SECADO.
Se recomienda revisar este grupo para confirmar la gestación, además de inducir el secado mamario y prepararlas para la próxima lactancia, dos meses antes del parto esperado.
Se recomienda revisar este grupo para confirmar la gestación, además de inducir el secado mamario y prepararlas para la próxima lactancia, dos meses antes del parto esperado.
TRATAMIENTO DE VACAS PROBLEMA.- En este grupo se incluirán las vacas que han sido inseminadas por más de 3 ocasiones (Repetidoras), con el fin de determinar la falla en la concepción. Por lo regular estos animales presentan procesos inflamatorios del útero, trompas o adherencias ováricas.
EVALUACION REPRODUCTIVA DEL HATO
El primer paso al asumir la dirección o manejo profesional de un hato ganadero, es el de determinar cual es el estado productivo y reproductivo del mismo. En el aspecto reproductivo debe realizarse el examen ginecológico de las hembras aptas reproductivamente, así como el examen andrológico de los reproductores. Luego y de acuerdo a los resultados obtenidos se harán los lotes de producción tales como, terneraje de cría, machos y hembras de levante, novillas de vientre, vacas paridas, vacas en producción, vacas horras, machos de levante, machos de ceba, toretes, toros reproductores.
Todo lo anterior implica la implementación de un sistema de registros sencillo, ágil, confiable y fácil de llevar, de tal manera que nos permita el análisis del comportamiento de la explotación, definir cual o cuales son los problemas que la afectan, sus posibles causas de acuerdo al tipo de animales, sistema de manejo, tipo de explotación, para de así fijar los objetivos y metas a lograr en un tiempo determinado. En la actualidad la mayoría de las explotaciones cuenta con un sistema básico de registros, los cuales se recomienda actualizar para su estudio y análisis correspondiente.
La inforrmación inicial se debe tomar en libretas de bolsillo, en la cual se anotará todo lo relacionado con detección de celos, servicios con toro o I.A, partos y nacimientos diarios, diagnósticos de gestación, tratamientos individuales y de grupo. Estos datos se trasladan a una tarjeta individual y/o a una base de datos de cada animal, que a su vez son enviados automáticamente a una hoja de cálculo, la cual muestra el comportamiento de los parámetros de todo el hato. La complejidad del sistema de registros aumenta al incrementarse el número de animales, lo que hace necesario la utilización de programas de software disponibles en el mercado, como el Taurus, Ganadero etc.
Existe una gran lista de indicadores o índices de eficiencia reproductiva, y el tipo de información que es posible evaluar es amplia y extensa, a veces innecesaria. Además ningún índice por si solo puede medir completamente el comportamiento reproductivo del hato. Cada índice tiene ventajas y desventajas. La correcta elección, interpretación y aplicación, marca la diferencia en cuanto a su habilidad diagnóstica y aplicabilidad.
El origen y la característica de los datos y registros utilizados para los cálculos es muy importante para obtener conclusiones, sin embargo, un solo parámetro no debe tomarse independientemente, por lo que el análisis de los registros obtenidos debe hacerse en conjunto y de manera integral. Es básico definir claramente cuales son los parámetros reproductivos considerados "normales", adoptados para cada explotación.
PARAMETROS REPRODUCTIVOS
Los parámetros a considerar se relacionan en la Tabla 1
Indice De Fertilidad IF
El Indice De Fertilidad nos permite analizar cuál es el comportamientoo reproductivo del hato. Dentro de éste parámetro se incluyen las hembras cargadas más las vacas vacias de menos de 100 días, las cuales no se consideran problema, sobre el total de vacas. Este parámetro puede tomarse por separado para vacas y novillas de vientre, dandonos el I.F para cada lote. Igualmente puede tomarse en conjunto lo que nos da el I.F. del hato.
Este I.F debe ser igual o mayor del 70%. Es de anotar que el promedio nacional se encuentra entre el 60-65%.
Intervalo Entre Partos IEP
Este parámetro nos dice cual ha sido la evolución reproductiva durante el último año y no nos indica cuál ha sido la eficiencia reproductiva durante el mismo período. Está influenciado principalmente por los Dias Abiertos. Sin embargo, si incluimos dentro de los registros al factor Intervalo Entre Partos Futuro IEPF, podemos evaluar el desarrollo y efectividad de las medidas adoptadas para el mejoramiento de la Eficiencia Reproductiva del Hato ERH.
El IEP no debe ser mayor a 420 días, correspondiente a 14 meses.
Dias De Espera Voluntario DEV
Es un factor a tener en cuenta, el cual se ha fijado entre 45 a 60 días postparto, con el fin de darle tiempo a que la hembra involucione adecuadamente el útero, reinicie la actividad ovárica, entre en un período de Balance Energético Positivo BEP y llegue a una CC aceptable de 3.0. Se considera que el celo más fértil es el más cercano a los 60 días postparto.
Este parámetro debe ser fijado de consenso entre el profesional y el ganadero. Algunos consideran que puede extenderse a los 70 días. Por tal razón el período en que la hembra debe quedar gestante es de 55 días, lo cual corresponde a 3 celos consecutivos, para que esté dentro de los 100 días postparto, considerados como optimos.
Dias Abiertos DA
Corresponde al período comprendido entre el parto y la concepción. La hembra que sobrepase los 100 días vacía se considera problema.
Una vez se ha determinado cuales parámetros están por fuera de los rangos considerados normales, es necesario precisar que grupo es el afectado (novillas, vacas postparto, vacas horras, vacas servidas). Enseguida se les practica un examen ginecológico exhaustivo a los animales problema, debiéndose hacer énfasis en la funcionalidad ovárica, presencia de catarros genitales, afecciones podales, toma de muestras para identificación de enfermedades reproductivas, condición corporal.
Por medio de la tinción LIVE/DEAD® de Sperm Viabity Kid (Figura 22), el espermatozoide vivo, el cual tiene la membrana intacta, se tiñe de verde fluorescente y los espermatozoides muertos se tiñen de rojo-naranja fluorescente. (MELLISHO)
Existe una gran lista de indicadores o índices de eficiencia reproductiva, y el tipo de información que es posible evaluar es amplia y extensa, a veces innecesaria. Además ningún índice por si solo puede medir completamente el comportamiento reproductivo del hato. Cada índice tiene ventajas y desventajas. La correcta elección, interpretación y aplicación, marca la diferencia en cuanto a su habilidad diagnóstica y aplicabilidad.
El origen y la característica de los datos y registros utilizados para los cálculos es muy importante para obtener conclusiones, sin embargo, un solo parámetro no debe tomarse independientemente, por lo que el análisis de los registros obtenidos debe hacerse en conjunto y de manera integral. Es básico definir claramente cuales son los parámetros reproductivos considerados "normales", adoptados para cada explotación.
PARAMETROS REPRODUCTIVOS
Los parámetros a considerar se relacionan en la Tabla 1
Indice De Fertilidad IF
El Indice De Fertilidad nos permite analizar cuál es el comportamientoo reproductivo del hato. Dentro de éste parámetro se incluyen las hembras cargadas más las vacas vacias de menos de 100 días, las cuales no se consideran problema, sobre el total de vacas. Este parámetro puede tomarse por separado para vacas y novillas de vientre, dandonos el I.F para cada lote. Igualmente puede tomarse en conjunto lo que nos da el I.F. del hato.
Este I.F debe ser igual o mayor del 70%. Es de anotar que el promedio nacional se encuentra entre el 60-65%.
Intervalo Entre Partos IEP
Este parámetro nos dice cual ha sido la evolución reproductiva durante el último año y no nos indica cuál ha sido la eficiencia reproductiva durante el mismo período. Está influenciado principalmente por los Dias Abiertos. Sin embargo, si incluimos dentro de los registros al factor Intervalo Entre Partos Futuro IEPF, podemos evaluar el desarrollo y efectividad de las medidas adoptadas para el mejoramiento de la Eficiencia Reproductiva del Hato ERH.
El IEP no debe ser mayor a 420 días, correspondiente a 14 meses.
Dias De Espera Voluntario DEV
Es un factor a tener en cuenta, el cual se ha fijado entre 45 a 60 días postparto, con el fin de darle tiempo a que la hembra involucione adecuadamente el útero, reinicie la actividad ovárica, entre en un período de Balance Energético Positivo BEP y llegue a una CC aceptable de 3.0. Se considera que el celo más fértil es el más cercano a los 60 días postparto.
Este parámetro debe ser fijado de consenso entre el profesional y el ganadero. Algunos consideran que puede extenderse a los 70 días. Por tal razón el período en que la hembra debe quedar gestante es de 55 días, lo cual corresponde a 3 celos consecutivos, para que esté dentro de los 100 días postparto, considerados como optimos.
Dias Abiertos DA
Corresponde al período comprendido entre el parto y la concepción. La hembra que sobrepase los 100 días vacía se considera problema.
Se calcula en base a la fecha de servicio efectivo en que la hembra queda gestante, de acuerdo a la fecha de diagnóstico de gestación, permitiendo fijar DA amplios. También se puede determinar restando al IEP los 282 días de la gestación, para obener los DA del hato en general. Si se da el caso en que menos del 15% de las vacas del hato no están preñadas a los 100 días después del parto, no hay razón para preocuparse ya que esos atrasos son normales, esta tasa es la esperada y el hato presenta sin duda una fecundidad excelente.
Está íntimamente relacionado con el período Parto Primer Servicio PPS y Servicios por Concepción SC, índices que están determinados por la eficiencia en la detección de celos, reinicio de la actividad ovárica y problemas uterinos postparto.
Lo que se observa corrientemente es que los DA son muy prolongados. En esta circunstancia se debe comprobar si el PEV fijado es amplio, debido a que el ganadero lo ha establecido de esta manera, para buscar un mayor período de lactancia y por consiguiente una mayor producción de leche.
Por el contrario, el período PPS puede ser menor del establecido en el PEV (menor de 40 días), lo que indicaría mal manejo de los registros o que el ganadero no está interesado en controlar el PEV. Este factor está influenciado en gran parte por la nutrición postparto, ya que un ración rica en energía induce la reiniciación de la actividad ovárica. Se recomienda efectuar una revisión rutinaria por palpación o ecografía a las vacas con 45 días postparto, algunos la efectuan a los 30 días, para saber si se inició la actividad ovárica, si es el caso habría deficiencias en la detección de celos; si no hay actividad se presenta anestro por ovarios no funcionales, caracterizados por ovarios pequeños sin estructuras palpables, con aspecto de mora o lisos, en cuyo caso se indica inducir médicamente la reiniciación de los celos.
Tasa De Detección De Celos
Está determinada por la intensidad o habilidad y exactitud del operador para detectar vacas en celo diariamente. Se define como el porcentaje de vacas aptas servidas durante un período de 21 días. (BECALUBA)
Adicionalmente, el número de veces diarias que son observadas las vacas, así como la duración y localización de estas observaciones, influye profundamente la TDC. Con base en esto la detección del celo debe efectuarse 3 a 4 veces al día, en períodos de 20 minutos cada uno, debidamente espaciados para alcanzar resultados adecuados. Existen ciertos factores que reducen la expresión del celo como: enfermedad, problemas podales, aciclia por deficiencias nutricionales y factores medioambientales como el estrés calórico. (FRICKE)
En los hatos en donde se practica la IATF la TDC se reemplaza por la Tasa de Servicios TS, puesto que en estos protocolos no es necesaria la detección del celo.
Tasa de Concepción TC
Se refiere al número de hembras diagnosticadas cargadas sobre el número de hembras servidas, ya sea por monta natural o IA.
Tasa de Preñez TP
Este parámetro mide dinámicamente y no históricamente la ERH, puesto que se evalúa cada 21 días y refleja rápidamente los cambios que hagamos en nuestro programa de reproducción, de manera que es posible hacer correcciones sobre la marcha, ver pronto sus resultados y determinar cuales vacas han sobrepasado el PEV.
La TP se obtiene multiplicando la TDC por la TC.
La Tabla 2 muestra los Indicadores de Eficiencia Reproductiva del Hato
Indice de Natalidad IN
Corresponde al porcentaje de nacimientos del total de hembras aptas reproductivamente. La natalidad debe superar el 80% anual, sin embargo, en la región tropical este índice se encuentra muy lejos de esta aspiración, pues comunmente no supera el 50%, e incluso en muchas ocasiones es iferior al 40%. En Cilombia los porcentajes de natalidad anual no superan el promedio en cuanto se refiere a IATF, lo que afecta negativamente la rentabilidad al igual que crea dificultad en los programas de selección genética. (SANTOS)
En las Tablas 3 - 4 - 5 - 6 se presentan algunos de los parámetros reportados en diferentes estudios y registros de asociaciones ganaderas.
Una vez se ha determinado cuales parámetros están por fuera de los rangos considerados normales, es necesario precisar que grupo es el afectado (novillas, vacas postparto, vacas horras, vacas servidas). Enseguida se les practica un examen ginecológico exhaustivo a los animales problema, debiéndose hacer énfasis en la funcionalidad ovárica, presencia de catarros genitales, afecciones podales, toma de muestras para identificación de enfermedades reproductivas, condición corporal.
Lo anterior permite tomar las medidas necesarias para mejorar la ER y productiva del Hato, teniendo en cuenta los siguientes puntos:
- Definir claramente el problema.
- Implementar un método que asegure su factibilidad económica.
- Concretar objetivos específicos en un período definido.
- Priorizar mediante una lista los pasos a ejecutar para lograr las metas fijadas.
- Discutir puntualmente los inconvenientes encontrados y la conducta a seguir antes de proceder al siguiente pasos.
- Evaluar periodicamente el desarrollo del programa fijado. (WEAVER)
El Manejo Reproductivo del hato se lleva acabo por medio de la Monta Natural MN o mediante técnicas de Reproducción Asistida, procesos que tienen como finalidad el mejoramiento genético y por consiguiente una aumento en la producción, tanto de leche como de carne.
Dentro de las Técnicas de Reproducción Asistida se cuenta con la Inducción de Celos IC, Sincronización de Celos SC. Inseminación Artificial IA, Inseminación a Tiempo Fijo IATF, Translanre de Embriones TE, en sus modalidades de TE en fresco o tradicional y TE a Tiempo Fijo TETF, tanto por los obtenidos por Superovulación SOV, como por Fertilización In Vitro FIV., Sexaje de Semen, Sexaje embriones, Vitrificación de Embriones.
Estas técnicas serán tratadas más específicamente en los capítulos siguientes.
Dentro de las Técnicas de Reproducción Asistida se cuenta con la Inducción de Celos IC, Sincronización de Celos SC. Inseminación Artificial IA, Inseminación a Tiempo Fijo IATF, Translanre de Embriones TE, en sus modalidades de TE en fresco o tradicional y TE a Tiempo Fijo TETF, tanto por los obtenidos por Superovulación SOV, como por Fertilización In Vitro FIV., Sexaje de Semen, Sexaje embriones, Vitrificación de Embriones.
Estas técnicas serán tratadas más específicamente en los capítulos siguientes.
MONTA NATURAL
Desde su iniciación la ganadería Colombiana se ha manejado reproductivamente mediante el empleo de la monta natural, utilizando toros nacionales procedentes de haciendas especializadas, en especial en la ganaderías de carne y doble propósito, por ello la escogencia del reproductor juega un papel importante en el éxito de la misma.
Si solamente producimos animales para exposición sin tener en cuenta su producción económica y su rentabilidad en carne, nos estamos engañando, haciendo grandes gastos que no tienen ninguna relación con el objetivo real de la ganadería. En la mayoría de los casos se da más importancia a la belleza en general que a la fertilidad. (ARBOUIN)
Hoy existe un buen número de ayudas aplicables al mejoramiento que son de gran utilidad en el desempeño reproductivo de los toros, no solo como ayuda diagnóstica sobre lo que ocurre a tal o cual ejemplar, sino de apoyo en el cumplimiento de las normas para animales de exposición en las diferentes asociaciones de razas bovinas en el país.
En la Tabla 7 observamos el
Frente a los tipos de concepción durante 2012, se incrementó el número de crías por FIV (4367), también aumento levemente la concepción por MN (24671), disminuyendo la IA y la TE (3052) con respecto a 2011.
Para 2012, el incremento de TE fue de 3.52% frente a 2011, reportando así 4112 lavados al finalizar el año, de los cuales 906 fueron embriones frescos, 3113 In Vitro y 93 embriones congelados (ASOCEBU).
Si solamente producimos animales para exposición sin tener en cuenta su producción económica y su rentabilidad en carne, nos estamos engañando, haciendo grandes gastos que no tienen ninguna relación con el objetivo real de la ganadería. En la mayoría de los casos se da más importancia a la belleza en general que a la fertilidad. (ARBOUIN)
Hoy existe un buen número de ayudas aplicables al mejoramiento que son de gran utilidad en el desempeño reproductivo de los toros, no solo como ayuda diagnóstica sobre lo que ocurre a tal o cual ejemplar, sino de apoyo en el cumplimiento de las normas para animales de exposición en las diferentes asociaciones de razas bovinas en el país.
En la Tabla 7 observamos el
comportamiento de la reproducción asistida en ganado cebú puro, datos correspondientes a los animales registrados en los años 2009 - 2012 en Asocebú.
Frente a los tipos de concepción durante 2012, se incrementó el número de crías por FIV (4367), también aumento levemente la concepción por MN (24671), disminuyendo la IA y la TE (3052) con respecto a 2011.
Para 2012, el incremento de TE fue de 3.52% frente a 2011, reportando así 4112 lavados al finalizar el año, de los cuales 906 fueron embriones frescos, 3113 In Vitro y 93 embriones congelados (ASOCEBU).
En el Gráfico 1 se representa el tipo de concepción mostrado en la Tabla 7
No siempre para el macho es una tarea fácil el reproducirse, el medio ambiente se levanta como una barrera difícil de sortear y golpea significativamente su desempeño en las condiciones climáticas naturales de Colombia, al igual que las enfermedades de tipo reproductivo frenan las cifras de alto desempeño.
Es penoso en realidad el manejo que damos a los toros con muchísima frecuencia, atentando no solo contra el adecuado desempeño, sino que induce y con frecuencia logra suspender de manera permanente y a veces irreversible, la posibilidad de generar algún tipo de descendencia. (ECHERERRY)
De otra parte es recomendable realizar cada año de manera rutinaria la evaluación del estado reproductivo del lote de toros del hato dedicados a la monta natural. Para el efecto se le debe dar un período de descanso previo, antes de su evaluación reproductiva, generalmente de un mes. Igualmente es conveniente solicitar la evaluación reproductiva del toro como requisito de compra, evaluación que es obligatoria para el ingreso a las ferias de exposición, según lo establecido por las diferentes asociaciones.
EVALUACION DE FERTILIDAD DEL REPRODUCTOR
Es una prueba que mediante un examen clínico y sitémico permite identificar la aptitud reproductiva del toro, así como los problemas de fertilidad que lo pueden afectar.
Como todo examen clínico se debe iniciar con la reseña del animal a evaluar. Seguidamente se continúa con el examen por inspección de la apariencia general y de los diferentes órganos y sistemas.

El reproductor debe manifestar las características propias de cada raza además de una apariencia mascuina relacionada con los niveles de testosterona.
La implantación de cada sección debe ser suave sin brusquedades, pecho ancho, arco costal amplio, costillas arqueadas anchas separadas, para dar profundidad tanto al torax como al abdomen, denotando gran capacidad.
Caderas amplias niveladas, espacio interisquiático amplio, inserción de la cola alta y suave; miembros con huesos anchos, fuertes y bien aplomados.

En el examen del sistema locomotor se observan los aplomos, localización de afecciones articulares, facilidad y forma de desplazamiento.
Es importante observar la posibilidad de presencia de laminitis en animales de establo con sobrepeso, así como de cuerpos extraños y panadizo en animales en pastoreo.
Se recomienda disponer de una hembra o grupo de hembras en celo, que permita determinar el grado de deseo sexual o líbido, su disposición y comportamiento a la monta.
El líbido en el macho se define como el deseo de montar a la hembra, mientras que la habilidad copulatoria es la capacidad de completar el servicio. Se debe recordar que no existe correlación entre líbido y perímetro testicular. Durante el examen funcional se debe prestar atención a la cadena de reflejos sexuales, para determinar la existencia de alguna patología que impida el correcto servicio.
La manera como el toro realiza el contacto con la hembra no es simple y refleja una serie de eventos fisiológicos complejos, los cuales requieren de una gran coordinación por parte del animal, lo cual incluye la búsqueda y detección, excitación, flehmen, erección y protrusión del pene, monta, penetración con o sin eyaculación.
EXAMEN DE ESTRUCTURAS EXTERNAS
Con el fin de efectuar el examen del tracto reproductivo, se introduce al animal en un brete o calceta, así como para protección del profesional. Luego se procede a la depilación, limpieza y palpación del prepucio, con el fin de determinar la presencia de nodulaciones, estrechez del orificio prepucial o heridas de cicatrización. Sirve igualmente para preparar el toro para la recolección del semen y toma de muestras prepuciales en busca de tricomona o agentes infecciosos.
 El examen del sistema reproductivo se inicia con la inspección del prepucio, observando la presencia de lesiones y deformaciones a éste nivel, determinando
su longitud, especialmente en la raza cebú, la cual no debe sobrepasar la línea imaginaria que va desde la punta del corvejón a la rodilla. Un prepucio largo predispone a la acrobstitis por lesión traumática del mismo. La mucosa prepucial no debe sobresalir del orificio prepucial o ser pendulante.
El examen del sistema reproductivo se inicia con la inspección del prepucio, observando la presencia de lesiones y deformaciones a éste nivel, determinando
su longitud, especialmente en la raza cebú, la cual no debe sobrepasar la línea imaginaria que va desde la punta del corvejón a la rodilla. Un prepucio largo predispone a la acrobstitis por lesión traumática del mismo. La mucosa prepucial no debe sobresalir del orificio prepucial o ser pendulante.
El examen del pene se puede realizar luego de la administración de un tranquilizante, lo cual permite su relajación y observación luego de examinar el prepucio. Sin embargo, por lo general se efectúa durante la recolección del semen mediante electroeyaculación, momento en el cual se protruye el pene por los estímulos eléctricos, facilitando su inspección.
En la evaluación anatómica se identifican heridas, inflamaciones, persistencia del frenillo, presencia de papilomas, tumores, hipoplasia del glande. En la evaluación funcional se debe prestar atención a los mecánismos de exteriorización, erección y reintrodución del pene y mucosa. En los terneros el pene se encuentra adosado al prepucio e inicia su desprendimiento cuando los testículos comienzan a hacerse funcionales de manera que es frecuente observar el frenilo en el pene durante el período prepuberal. (MORILLO)
 Se continúa con el examen de los testículos los cuales están contenidos dentro de la bolsa escrotal. Se evaluarán por palpación los conductos deferentes y el paquete vasculonervioso, que constituyen el cordón espermático, el epidídimo, saco escrotal o escroto, circunferencia escrotal o testicular y testículos propiamente dichos, en donde se observarán la forma, consistencia y movilidad dentro del saco escrotal.
Se continúa con el examen de los testículos los cuales están contenidos dentro de la bolsa escrotal. Se evaluarán por palpación los conductos deferentes y el paquete vasculonervioso, que constituyen el cordón espermático, el epidídimo, saco escrotal o escroto, circunferencia escrotal o testicular y testículos propiamente dichos, en donde se observarán la forma, consistencia y movilidad dentro del saco escrotal.
La Circunferencia Escrotal C.E o Circunferencia Testicular C.T, es una medida importante ya que está directamente relacionada con el total del Volumen Espermático producido, con la normalidad del esperma y el inicio de la pubertad en el toro y sus hijas. Los toros con una C.E grande producirán más esperma con normalidad incrementada. (SPROTT)
La C.E da una idea del tamaño de los testículos, es una característica altamente heredable, relacionada con la precocidad de las hijas. (ECHEVERRI)
 La producción diaria de espermatozoides en el toro es unos 10 a 20 millones por gramo de parénquima, por lo tanto, a mayor C.E mayor producción de espermatozoides y reserva espermática.
La producción diaria de espermatozoides en el toro es unos 10 a 20 millones por gramo de parénquima, por lo tanto, a mayor C.E mayor producción de espermatozoides y reserva espermática.
La C.E está relacionada con la calidad seminal. Aproximadamente el 4 - 4.6% de los toros con C.E igual o superior a 30 cm, tiene calidad de semen cuestionable y aproximadamente un 2% tiene baja calidad, ientras que toros con C.E menor de 30 cm rara vez presentan semen de calidad satisfactoria.
Tanto investigadores Americanos como Australianos han demostrado de manera concluyente que los testículos pequeños están asociados con baja calidad seminal y menor produción espermática. Toros con C.E menor de 30 cms con buena calidad seminal, obtuvieron bajos índices de preñez por volumen de eyaculado insuficiente, cuando el hato presentaba altos índices de celo diario. (BOGGIO)
Con la yema de los dedos podemos palpar la consistencia o tono testicular T.T y esto está altamente relacionado con la calidad del semen que van a producir los testículos. Los testículos blandos son de mal pronóstico reproductivo. La presencia de cicatrices, nodulaciones o protuberancias son signos de fibrosis testicular, la cual altera la calidad del mismo.
 La piel del escroto debe ser lisa y plegable, de naturaleza delgada, sin accidentes o protuberancias. igualmente, el testículo debe tener amplia movilidad dentro del escroto, lo que facilita su retracción o descenso según la temperatura ambiente y por lo tanto el control de la temperatura corporal del mismo.
La piel del escroto debe ser lisa y plegable, de naturaleza delgada, sin accidentes o protuberancias. igualmente, el testículo debe tener amplia movilidad dentro del escroto, lo que facilita su retracción o descenso según la temperatura ambiente y por lo tanto el control de la temperatura corporal del mismo.
Puede afirmarse que no existen dos testículos de igual tamaño, siempre habrá una diferencia entre uno y otro, lo importante ess definir cuál es la diferencia que sería permisible. La sociedad De Teriogenología dentro de las normas para la Evaluación Reproductiva De Los Toros BSE, se considera que las diferencias de tamaño entre uno y otro testículo no deben exceder el 25%, sin embargo otros autores recientemente consideran que no debe ser mayor del 10%. (ECHEVERRI)
Mediante la palpación podemos dilucidar si hay o no asimetría. En la parte derecha de la Figura 10 se evidencia como el pulgar izquierdo tiene que extenderse en su totalidad para abarcar éste testículo, no así el derecho. Esta es una manera fácil de aclarar una posible duda.
El tamaño testicular máximo se alcanza a los 4 a 6 años de edad. En toros de 5 a 8 años y mayores, la C.E pude ser una medida un poco menos exacta en la producción de espermios, ya que algunos túbulos seminóeros pueden volverse inactivos, sin que esto se acompañe de una reducción en el tamaño testicular. (DUCHENS)
La asimetría puede ser de origen hereditario como en le caso de la hipoplasia, lo cual se transmite a la descendencia, produciendo hipoplasia ovárica en las hembras. Igualmente pued ser adquirida como sucede en el hidrocele o hematocele, entidades que son tratables.
La forma del testículo es generalmente ovoide y alargada, con su eje mayor en sentido vertical. Sin embargo se presenta una gran cantidad de formas, que varían de longitud y proporción entre sus ejes, todas ellas aceptables siempre y cuando el mecanismo de termorregulación dependiente del ascenso y descenso de los testículos, no se vea afectado.
El testículo de base hendida causa mucho recelo, sin embargo no tiene ningún tipo de objeción, siempre y cuando sus componentes epididimarios se encuentren bien.
Los testículos de forma globosa, abultada o redonda, son frecuentes en toros cebú, no son un inconveniente reproductivo. (ECHEVERRI).
Normalmente los epidídimos son poco protruidos, sin embargo en ganado cebú hay casos en que son bien manifiestos, más en unos que en otros, sin que sea problemático. Puesto que es el sitio de almacenamiento y maduración de los espermatozoides, se debe poner cuidado especial a esta región, pues es susceptible de traumatismos y está predispuesta a inflamaciones. Aunque no es frecuente hay casos en que se presenta ausencia de la cola del epidídimo, lo que impide el paso de los espermatozoides, siendo su causa congénita y por consiguiente es causa de descarte del animal.
EVALUACION ESTRUCTURAS INTERNAS
Una vez realizado el examen de las estructuras externas se continúa co el examen de las estructuras internas del tracto reproductivo, mediante palpación transrectal.
Los órganos genitales internos del toro, están constituidos por la uretra pélvica, la ampolla de los conductos deferentes, la próstata, glándulas seminales y glándulas bulbouretrales, éstas últimas no palpables.
La uretra pelvica se localiza en el centro del piso de la pelvis, como una estructura firme cilíndrica, aplanada, de un diámetro de 3 a 4 cms.
Un poco por delante se aprecia la próstata, de la cual solamente es palpable el cuerpo, ya que el resto se encuentra diseminado entre los músculos que recubren la uretra pelvica.
Las glándulas seminales son pares y se ubican colocando la mano en el extremo anterior de la uretra pelvica, efectuando movimientos suaves laterales. Son de forma lobulada de aproximadamente 10 a 15 cms de largo, por 3 cms de ancho. Su tamaño varía de acuerdo a la raza y la edad. Se debe descartar la presencia de aumento de tamaño. focos de endurecimiento o reblandecimiento y dolor a la palpación. Se observa en algunos casos, que el toro emite cantidades variables de líquido seminal a la palpación y masaje de éstas glándulas.
La lesión más comunmente encontrada en las glándulas seminales, es la inflamación o vesiculitis, la cual se caracteriza por la presencia de dolor a la palpación, aumento de tamaño, pérdida de las lobulaciones y adherencias. En algunos casos las glándulas se pueden palpar duras y fibroticas. Cualquier asimetría debe ser considerada como de pronóstico reservado. En algunos casos de vesiculitis se puede observar partículas de pus en el eyaculado.
Las ampollas o ampulas son el segmento terminal ensanchado de los conductos deferentes; mide entre 10 a 15 cms de largo y se sienten al hacer presión en el piso de la cavidad pélvica, entre las glándulas seminales. Se palpan como dos estructuras semiduras del grosor de un lápiz.
EXAMEN DEL SEMEN
Una vez efectuado el examen del tracto genital, se continúa con la evaluación del eyaculado y la calidad seminal.
La recolección de la muestra del eyaculado se realiza actualmente mediante vagina artificial o electroeyaculación, Técnicas que deben llenar estrictas medidas de limpieza y sanidad.
La recolección con vagina artificial se lleva a cabo ne toros adiestrados especialmente, por lo general con miras a la obtención de semen para la elaboración de pajillas con destino a inseminación artificial. La muestra es muy representativa en cuanto a la calidad del eyaculado, ya que semeja una monta y eyaculado natural.
La recolección del eyaculado utilizando electroeyaculador, se emplea en la evaluación de la fertilidad de toros en servicio por monta natural, compraventa de reproductores y como requisito exigido por las asociaciones respectivas a ejemplares
de exposición.
Con anterioridad a este examen se recomienda retirar el toro de la vacada, durante un período de 3 a 4 días o más, a criterio del profesional, con el fin de lograr la acumulación de semen en el epidídimo.
Inicialmente se efectúa la evacuación de la materia fecal del recto durante la cual se recomienda realizar un masaje longitudinal sobre las ampollas deferentes y el músculo uretral.
Lubrique con gel la sonda o bala, antes de insertarla en el recto, con los electrodos dirigidos ventralmente. Asegúrese que el electroeyaculador esté encendido antes de introducirlo, con el mínimo estímulo. Si el aparato se enciende luego de su introducción, se corre el riesgo que el animal reciba una fuerte descarga eléctrica, lo cual puede lesionarlo o estresarlo innecesariamente.
La estimulación se inicia con pulsos bajos y ascendentes hasta que el toro muestre una respuesta mínima. Luego continúe con estímulos de mayor intensidad, a frecuencias de 1 a 2 segundos a intervalos de 1 segundo de descanso. Durante éste proceso el pene alcanza a el estado de erección y protrusión por el orificio prepucial, estando indicado efectuar un masaje a lo largo de ésta región junto con la atención del operador a la recolección de la muestra.
Después de un corto descanso, se efectúa un segundo intento de recolección con impulsos de 2 voltios por debajo del estímulo máximo, intento que es con frecuencia exitoso.
Existen varios equipos para electroeyaculación, que dependen del operario o tienen un programa automático que inicia con la presión de un botón. Estos últimos son muy útiles sobretodo cuando hay poca ayuda de personal. (JIMENEZ)
El semen colectado con VA suele ser más concentrado y limpio que el de las muestras de semen colectadas por electroeyaculación.
EVALUACION DE LA CALIDAD SEMINAL
La capacidad de producción de semen por gramo de tejido testicular o Producción Diaria de Espermatozoides PDE, está directamente relacionada con la circunferencia escrotal CE, en toros jóvenes. En los toros que están sometidos a un régimen periódico de colección de semen, el volumen y la concentración espermática son indicadores de la capacidad para producir espermatozoides y le permite a los centros de IA, hacer un seguimiento de la función testicular de los mismos.
La evaluación del semen comprende la determinación del volumen, color, densidad, olor, pH, motilidad masal e individual.
El volumen seminal varía de acuerdo a cada animal y al tipo de técnica de recolección utilizada.
El color está relacionado con la densidad o concentración de espermatozoides, de manera subjetiva.
Cremoso Muy buena mayor a 750 millones/ml
Lechoso Buena 400 a 750 millones/ml
Blanquecino Regular 250 a 400 millones/ml
Traslúcido Mala menor a 200 millones/ml
Colores anormales:
Amarillo Presencia de pus u orina
Rojizo o rosado Presencia de sangre fresca
Pardo o marrón Presencia de sangre vieja
Amarillo verdoso Contaminación con Pseudomona aeruginosa o tratados con Vit. B12
DENSIDAD ESPERMATICA
Actualmente la densidad se valúa mediante el empleo de un espectrofotómetro, el cual mide indirectamente la concentración espermática, en base a la absorción o dispersión de la luz provocada por los espermatozoides en suspensión. Es un método rápido y fácil, con un margen de error bajo. Igualmente se utiliza el fotómetro spermacue minitube para muestras de semen fresco, con indicación digital de la densidad de células espermáticas en millonnes/ml. Estos dos tipos de medición sirven para calcular la cantidad de diluyente del semen a agregar y el número de pajillas que se pueden obtener de un eyaculado en particular. (Figura 18)
Tabla 9.- Muestra la clasificación macroscopica de la densidad del semen según el número de espermatozoides.
El olor se define como característico o suigéneris.
El pH se mide con un papel indicador, el cual se coloca en el semen sin diluir inmediatamente después de su recolección y poco después de diluir la muestra; para ello se deja caer una gota de semen mediante una pipeta capilar sobre el papel indicador y el resto humedecido de éste se compara inmediatamente con la escala de color de pH. El pH varía de 6.4 a 7.0 como valor normal. Cuando tiende a la alcalinidad , debido a la disminución en la producción de ácido cítrico por parte de la próstata. Valores extremadamente ácidos de 6.5 se observa en casos de agensia u oclusión de las glándulas seminales.
MOTILIDAD ESPERMATICA
La motilidad espermática se valúa dentro de dos parámetros, la motilidad masal y la motilidad individual.
 La evaluación de la motilidad masal indica la capacidad de movimiento de los espermatozoides en el eyaculado como un todo. Para su determinación se toma con una pipeta una gota de semen entero (regularmente contiene 10 a 20 microlitros) y se coloca sobre un portaobjeto temperado a 37°C en una platina termorregulada adaptada al respecto y se observa sin cubreobjeto, en campo claro a un aumento de 4X -10X (Figura 19)
La evaluación de la motilidad masal indica la capacidad de movimiento de los espermatozoides en el eyaculado como un todo. Para su determinación se toma con una pipeta una gota de semen entero (regularmente contiene 10 a 20 microlitros) y se coloca sobre un portaobjeto temperado a 37°C en una platina termorregulada adaptada al respecto y se observa sin cubreobjeto, en campo claro a un aumento de 4X -10X (Figura 19)
 Tabla 10. Motilidad masal.
Tabla 10. Motilidad masal.
El movimiento en masa depende de tres factores: concentración espermática, porcentaje de espermatozoides móviles en progresión lineal y velocidad de progresión de los espermatozoides. La Tabla 10 muestra la Clasificación de la motilidad masal.

Figura 20. Motilidad individual
Corresponde al porcentaje al porcentaje de células espermáticas móviles en un campo microscópico. Se observa al microscopio entre 200 X y 400 X, preferiblemente de contraste de fase. Es una evaluación cuantitativa y cualitativa ya que se determina el porcentaje y el tipo de movimiento de las células espermáticas, el cual puede ser progresivo lineal, progresivo no lineal, errático, no progresivo o inmóviles.
Es penoso en realidad el manejo que damos a los toros con muchísima frecuencia, atentando no solo contra el adecuado desempeño, sino que induce y con frecuencia logra suspender de manera permanente y a veces irreversible, la posibilidad de generar algún tipo de descendencia. (ECHERERRY)
De otra parte es recomendable realizar cada año de manera rutinaria la evaluación del estado reproductivo del lote de toros del hato dedicados a la monta natural. Para el efecto se le debe dar un período de descanso previo, antes de su evaluación reproductiva, generalmente de un mes. Igualmente es conveniente solicitar la evaluación reproductiva del toro como requisito de compra, evaluación que es obligatoria para el ingreso a las ferias de exposición, según lo establecido por las diferentes asociaciones.
EVALUACION DE FERTILIDAD DEL REPRODUCTOR
Es una prueba que mediante un examen clínico y sitémico permite identificar la aptitud reproductiva del toro, así como los problemas de fertilidad que lo pueden afectar.
Como todo examen clínico se debe iniciar con la reseña del animal a evaluar. Seguidamente se continúa con el examen por inspección de la apariencia general y de los diferentes órganos y sistemas.

El reproductor debe manifestar las características propias de cada raza además de una apariencia mascuina relacionada con los niveles de testosterona.
La implantación de cada sección debe ser suave sin brusquedades, pecho ancho, arco costal amplio, costillas arqueadas anchas separadas, para dar profundidad tanto al torax como al abdomen, denotando gran capacidad.
Caderas amplias niveladas, espacio interisquiático amplio, inserción de la cola alta y suave; miembros con huesos anchos, fuertes y bien aplomados.

En el examen del sistema locomotor se observan los aplomos, localización de afecciones articulares, facilidad y forma de desplazamiento.
Es importante observar la posibilidad de presencia de laminitis en animales de establo con sobrepeso, así como de cuerpos extraños y panadizo en animales en pastoreo.
Se recomienda disponer de una hembra o grupo de hembras en celo, que permita determinar el grado de deseo sexual o líbido, su disposición y comportamiento a la monta.
El líbido en el macho se define como el deseo de montar a la hembra, mientras que la habilidad copulatoria es la capacidad de completar el servicio. Se debe recordar que no existe correlación entre líbido y perímetro testicular. Durante el examen funcional se debe prestar atención a la cadena de reflejos sexuales, para determinar la existencia de alguna patología que impida el correcto servicio.
La manera como el toro realiza el contacto con la hembra no es simple y refleja una serie de eventos fisiológicos complejos, los cuales requieren de una gran coordinación por parte del animal, lo cual incluye la búsqueda y detección, excitación, flehmen, erección y protrusión del pene, monta, penetración con o sin eyaculación.
EXAMEN DE ESTRUCTURAS EXTERNAS
Con el fin de efectuar el examen del tracto reproductivo, se introduce al animal en un brete o calceta, así como para protección del profesional. Luego se procede a la depilación, limpieza y palpación del prepucio, con el fin de determinar la presencia de nodulaciones, estrechez del orificio prepucial o heridas de cicatrización. Sirve igualmente para preparar el toro para la recolección del semen y toma de muestras prepuciales en busca de tricomona o agentes infecciosos.
 El examen del sistema reproductivo se inicia con la inspección del prepucio, observando la presencia de lesiones y deformaciones a éste nivel, determinando
El examen del sistema reproductivo se inicia con la inspección del prepucio, observando la presencia de lesiones y deformaciones a éste nivel, determinando El examen del pene se puede realizar luego de la administración de un tranquilizante, lo cual permite su relajación y observación luego de examinar el prepucio. Sin embargo, por lo general se efectúa durante la recolección del semen mediante electroeyaculación, momento en el cual se protruye el pene por los estímulos eléctricos, facilitando su inspección.
En la evaluación anatómica se identifican heridas, inflamaciones, persistencia del frenillo, presencia de papilomas, tumores, hipoplasia del glande. En la evaluación funcional se debe prestar atención a los mecánismos de exteriorización, erección y reintrodución del pene y mucosa. En los terneros el pene se encuentra adosado al prepucio e inicia su desprendimiento cuando los testículos comienzan a hacerse funcionales de manera que es frecuente observar el frenilo en el pene durante el período prepuberal. (MORILLO)
 Se continúa con el examen de los testículos los cuales están contenidos dentro de la bolsa escrotal. Se evaluarán por palpación los conductos deferentes y el paquete vasculonervioso, que constituyen el cordón espermático, el epidídimo, saco escrotal o escroto, circunferencia escrotal o testicular y testículos propiamente dichos, en donde se observarán la forma, consistencia y movilidad dentro del saco escrotal.
Se continúa con el examen de los testículos los cuales están contenidos dentro de la bolsa escrotal. Se evaluarán por palpación los conductos deferentes y el paquete vasculonervioso, que constituyen el cordón espermático, el epidídimo, saco escrotal o escroto, circunferencia escrotal o testicular y testículos propiamente dichos, en donde se observarán la forma, consistencia y movilidad dentro del saco escrotal.La Circunferencia Escrotal C.E o Circunferencia Testicular C.T, es una medida importante ya que está directamente relacionada con el total del Volumen Espermático producido, con la normalidad del esperma y el inicio de la pubertad en el toro y sus hijas. Los toros con una C.E grande producirán más esperma con normalidad incrementada. (SPROTT)
La C.E da una idea del tamaño de los testículos, es una característica altamente heredable, relacionada con la precocidad de las hijas. (ECHEVERRI)
 La producción diaria de espermatozoides en el toro es unos 10 a 20 millones por gramo de parénquima, por lo tanto, a mayor C.E mayor producción de espermatozoides y reserva espermática.
La producción diaria de espermatozoides en el toro es unos 10 a 20 millones por gramo de parénquima, por lo tanto, a mayor C.E mayor producción de espermatozoides y reserva espermática. La C.E está relacionada con la calidad seminal. Aproximadamente el 4 - 4.6% de los toros con C.E igual o superior a 30 cm, tiene calidad de semen cuestionable y aproximadamente un 2% tiene baja calidad, ientras que toros con C.E menor de 30 cm rara vez presentan semen de calidad satisfactoria.
Tanto investigadores Americanos como Australianos han demostrado de manera concluyente que los testículos pequeños están asociados con baja calidad seminal y menor produción espermática. Toros con C.E menor de 30 cms con buena calidad seminal, obtuvieron bajos índices de preñez por volumen de eyaculado insuficiente, cuando el hato presentaba altos índices de celo diario. (BOGGIO)
Con la yema de los dedos podemos palpar la consistencia o tono testicular T.T y esto está altamente relacionado con la calidad del semen que van a producir los testículos. Los testículos blandos son de mal pronóstico reproductivo. La presencia de cicatrices, nodulaciones o protuberancias son signos de fibrosis testicular, la cual altera la calidad del mismo.
 La piel del escroto debe ser lisa y plegable, de naturaleza delgada, sin accidentes o protuberancias. igualmente, el testículo debe tener amplia movilidad dentro del escroto, lo que facilita su retracción o descenso según la temperatura ambiente y por lo tanto el control de la temperatura corporal del mismo.
La piel del escroto debe ser lisa y plegable, de naturaleza delgada, sin accidentes o protuberancias. igualmente, el testículo debe tener amplia movilidad dentro del escroto, lo que facilita su retracción o descenso según la temperatura ambiente y por lo tanto el control de la temperatura corporal del mismo.Puede afirmarse que no existen dos testículos de igual tamaño, siempre habrá una diferencia entre uno y otro, lo importante ess definir cuál es la diferencia que sería permisible. La sociedad De Teriogenología dentro de las normas para la Evaluación Reproductiva De Los Toros BSE, se considera que las diferencias de tamaño entre uno y otro testículo no deben exceder el 25%, sin embargo otros autores recientemente consideran que no debe ser mayor del 10%. (ECHEVERRI)
Mediante la palpación podemos dilucidar si hay o no asimetría. En la parte derecha de la Figura 10 se evidencia como el pulgar izquierdo tiene que extenderse en su totalidad para abarcar éste testículo, no así el derecho. Esta es una manera fácil de aclarar una posible duda.
El tamaño testicular máximo se alcanza a los 4 a 6 años de edad. En toros de 5 a 8 años y mayores, la C.E pude ser una medida un poco menos exacta en la producción de espermios, ya que algunos túbulos seminóeros pueden volverse inactivos, sin que esto se acompañe de una reducción en el tamaño testicular. (DUCHENS)
La asimetría puede ser de origen hereditario como en le caso de la hipoplasia, lo cual se transmite a la descendencia, produciendo hipoplasia ovárica en las hembras. Igualmente pued ser adquirida como sucede en el hidrocele o hematocele, entidades que son tratables.
La forma del testículo es generalmente ovoide y alargada, con su eje mayor en sentido vertical. Sin embargo se presenta una gran cantidad de formas, que varían de longitud y proporción entre sus ejes, todas ellas aceptables siempre y cuando el mecanismo de termorregulación dependiente del ascenso y descenso de los testículos, no se vea afectado.
El testículo de base hendida causa mucho recelo, sin embargo no tiene ningún tipo de objeción, siempre y cuando sus componentes epididimarios se encuentren bien.
Los testículos de forma globosa, abultada o redonda, son frecuentes en toros cebú, no son un inconveniente reproductivo. (ECHEVERRI).
Normalmente los epidídimos son poco protruidos, sin embargo en ganado cebú hay casos en que son bien manifiestos, más en unos que en otros, sin que sea problemático. Puesto que es el sitio de almacenamiento y maduración de los espermatozoides, se debe poner cuidado especial a esta región, pues es susceptible de traumatismos y está predispuesta a inflamaciones. Aunque no es frecuente hay casos en que se presenta ausencia de la cola del epidídimo, lo que impide el paso de los espermatozoides, siendo su causa congénita y por consiguiente es causa de descarte del animal.
EVALUACION ESTRUCTURAS INTERNAS
Una vez realizado el examen de las estructuras externas se continúa co el examen de las estructuras internas del tracto reproductivo, mediante palpación transrectal.
Los órganos genitales internos del toro, están constituidos por la uretra pélvica, la ampolla de los conductos deferentes, la próstata, glándulas seminales y glándulas bulbouretrales, éstas últimas no palpables.
La uretra pelvica se localiza en el centro del piso de la pelvis, como una estructura firme cilíndrica, aplanada, de un diámetro de 3 a 4 cms.
Un poco por delante se aprecia la próstata, de la cual solamente es palpable el cuerpo, ya que el resto se encuentra diseminado entre los músculos que recubren la uretra pelvica.
Las glándulas seminales son pares y se ubican colocando la mano en el extremo anterior de la uretra pelvica, efectuando movimientos suaves laterales. Son de forma lobulada de aproximadamente 10 a 15 cms de largo, por 3 cms de ancho. Su tamaño varía de acuerdo a la raza y la edad. Se debe descartar la presencia de aumento de tamaño. focos de endurecimiento o reblandecimiento y dolor a la palpación. Se observa en algunos casos, que el toro emite cantidades variables de líquido seminal a la palpación y masaje de éstas glándulas.
La lesión más comunmente encontrada en las glándulas seminales, es la inflamación o vesiculitis, la cual se caracteriza por la presencia de dolor a la palpación, aumento de tamaño, pérdida de las lobulaciones y adherencias. En algunos casos las glándulas se pueden palpar duras y fibroticas. Cualquier asimetría debe ser considerada como de pronóstico reservado. En algunos casos de vesiculitis se puede observar partículas de pus en el eyaculado.
Las ampollas o ampulas son el segmento terminal ensanchado de los conductos deferentes; mide entre 10 a 15 cms de largo y se sienten al hacer presión en el piso de la cavidad pélvica, entre las glándulas seminales. Se palpan como dos estructuras semiduras del grosor de un lápiz.
EXAMEN DEL SEMEN
Una vez efectuado el examen del tracto genital, se continúa con la evaluación del eyaculado y la calidad seminal.
La recolección de la muestra del eyaculado se realiza actualmente mediante vagina artificial o electroeyaculación, Técnicas que deben llenar estrictas medidas de limpieza y sanidad.
La recolección con vagina artificial se lleva a cabo ne toros adiestrados especialmente, por lo general con miras a la obtención de semen para la elaboración de pajillas con destino a inseminación artificial. La muestra es muy representativa en cuanto a la calidad del eyaculado, ya que semeja una monta y eyaculado natural.
La recolección del eyaculado utilizando electroeyaculador, se emplea en la evaluación de la fertilidad de toros en servicio por monta natural, compraventa de reproductores y como requisito exigido por las asociaciones respectivas a ejemplares
de exposición.
Con anterioridad a este examen se recomienda retirar el toro de la vacada, durante un período de 3 a 4 días o más, a criterio del profesional, con el fin de lograr la acumulación de semen en el epidídimo.
Inicialmente se efectúa la evacuación de la materia fecal del recto durante la cual se recomienda realizar un masaje longitudinal sobre las ampollas deferentes y el músculo uretral.
Lubrique con gel la sonda o bala, antes de insertarla en el recto, con los electrodos dirigidos ventralmente. Asegúrese que el electroeyaculador esté encendido antes de introducirlo, con el mínimo estímulo. Si el aparato se enciende luego de su introducción, se corre el riesgo que el animal reciba una fuerte descarga eléctrica, lo cual puede lesionarlo o estresarlo innecesariamente.
La estimulación se inicia con pulsos bajos y ascendentes hasta que el toro muestre una respuesta mínima. Luego continúe con estímulos de mayor intensidad, a frecuencias de 1 a 2 segundos a intervalos de 1 segundo de descanso. Durante éste proceso el pene alcanza a el estado de erección y protrusión por el orificio prepucial, estando indicado efectuar un masaje a lo largo de ésta región junto con la atención del operador a la recolección de la muestra.
Después de un corto descanso, se efectúa un segundo intento de recolección con impulsos de 2 voltios por debajo del estímulo máximo, intento que es con frecuencia exitoso.
Existen varios equipos para electroeyaculación, que dependen del operario o tienen un programa automático que inicia con la presión de un botón. Estos últimos son muy útiles sobretodo cuando hay poca ayuda de personal. (JIMENEZ)
El semen colectado con VA suele ser más concentrado y limpio que el de las muestras de semen colectadas por electroeyaculación.
EVALUACION DE LA CALIDAD SEMINAL
La capacidad de producción de semen por gramo de tejido testicular o Producción Diaria de Espermatozoides PDE, está directamente relacionada con la circunferencia escrotal CE, en toros jóvenes. En los toros que están sometidos a un régimen periódico de colección de semen, el volumen y la concentración espermática son indicadores de la capacidad para producir espermatozoides y le permite a los centros de IA, hacer un seguimiento de la función testicular de los mismos.
La evaluación del semen comprende la determinación del volumen, color, densidad, olor, pH, motilidad masal e individual.
El volumen seminal varía de acuerdo a cada animal y al tipo de técnica de recolección utilizada.
El color está relacionado con la densidad o concentración de espermatozoides, de manera subjetiva.
Cremoso Muy buena mayor a 750 millones/ml
Lechoso Buena 400 a 750 millones/ml
Blanquecino Regular 250 a 400 millones/ml
Traslúcido Mala menor a 200 millones/ml
Colores anormales:
Amarillo Presencia de pus u orina
Rojizo o rosado Presencia de sangre fresca
Pardo o marrón Presencia de sangre vieja
Amarillo verdoso Contaminación con Pseudomona aeruginosa o tratados con Vit. B12
DENSIDAD ESPERMATICA
Actualmente la densidad se valúa mediante el empleo de un espectrofotómetro, el cual mide indirectamente la concentración espermática, en base a la absorción o dispersión de la luz provocada por los espermatozoides en suspensión. Es un método rápido y fácil, con un margen de error bajo. Igualmente se utiliza el fotómetro spermacue minitube para muestras de semen fresco, con indicación digital de la densidad de células espermáticas en millonnes/ml. Estos dos tipos de medición sirven para calcular la cantidad de diluyente del semen a agregar y el número de pajillas que se pueden obtener de un eyaculado en particular. (Figura 18)
Tabla 9.- Muestra la clasificación macroscopica de la densidad del semen según el número de espermatozoides.
El olor se define como característico o suigéneris.
El pH se mide con un papel indicador, el cual se coloca en el semen sin diluir inmediatamente después de su recolección y poco después de diluir la muestra; para ello se deja caer una gota de semen mediante una pipeta capilar sobre el papel indicador y el resto humedecido de éste se compara inmediatamente con la escala de color de pH. El pH varía de 6.4 a 7.0 como valor normal. Cuando tiende a la alcalinidad , debido a la disminución en la producción de ácido cítrico por parte de la próstata. Valores extremadamente ácidos de 6.5 se observa en casos de agensia u oclusión de las glándulas seminales.
MOTILIDAD ESPERMATICA
La motilidad espermática se valúa dentro de dos parámetros, la motilidad masal y la motilidad individual.
 La evaluación de la motilidad masal indica la capacidad de movimiento de los espermatozoides en el eyaculado como un todo. Para su determinación se toma con una pipeta una gota de semen entero (regularmente contiene 10 a 20 microlitros) y se coloca sobre un portaobjeto temperado a 37°C en una platina termorregulada adaptada al respecto y se observa sin cubreobjeto, en campo claro a un aumento de 4X -10X (Figura 19)
La evaluación de la motilidad masal indica la capacidad de movimiento de los espermatozoides en el eyaculado como un todo. Para su determinación se toma con una pipeta una gota de semen entero (regularmente contiene 10 a 20 microlitros) y se coloca sobre un portaobjeto temperado a 37°C en una platina termorregulada adaptada al respecto y se observa sin cubreobjeto, en campo claro a un aumento de 4X -10X (Figura 19) Tabla 10. Motilidad masal.
Tabla 10. Motilidad masal.El movimiento en masa depende de tres factores: concentración espermática, porcentaje de espermatozoides móviles en progresión lineal y velocidad de progresión de los espermatozoides. La Tabla 10 muestra la Clasificación de la motilidad masal.

Figura 20. Motilidad individual
Corresponde al porcentaje al porcentaje de células espermáticas móviles en un campo microscópico. Se observa al microscopio entre 200 X y 400 X, preferiblemente de contraste de fase. Es una evaluación cuantitativa y cualitativa ya que se determina el porcentaje y el tipo de movimiento de las células espermáticas, el cual puede ser progresivo lineal, progresivo no lineal, errático, no progresivo o inmóviles.
Para observar éste movimiento se recomienda diluir la muestra de semen 1 a 100 en una solución isotónica de citrato de sodio al 2.9% o cloruro de sodio al 0.9%. (MORILLO)
Tabla 11. Clasificación de la Motilidad Individual.
Tabla 12. Clasificación de la Motilidad Espermática.
La aparición de los sistemas informáticos de digitalización de imágenes abrió un nuevo campo en el estudio de la motilidad de los espermatozoides. Estos sistemas, denominados genéricamente CASA (Computer Assisted Motiliti Analysis), han automatizado y simplificado el proceso. El CASA establece, de una manera efectiva, medidas cuantitativas del movimiento individual de los espermatozoides. Con éste tipo de análisis se espera obtener medidas correctas de la motilidad espermática que proporcionen información precisa acerca del estado funcional del axonema y de las membranas espermáticas.
Los sistemas automáticos de medición de imágenes se basan en la captura sucesiva de espermatozoides en movimiento provenientes de un microscopio. Esta imágenes se digitalizan identificando las células espermáticas que contienen la primera imagen.
Los parámetros determinados para cada espermatozoide son la
velocidad de movimiento sobre la base de varios descriptores,
las trayectorias que realiza la cabeza del espermatozoide y la frecuencia de los cambios de dirección que efectúa. (HIDALGO)
Actualmente existen en el mercado varios tipos de CASA que registran el movimiento espermático y loa analizan, tanto en tiempo real, como de manera diferida, aportando una gran cantidad de información. Cada uno de los sistemas CASA deben calibrarse según la especie.
MORFOLOGIA
El análisis morfológico de los espermatozoides es uno de los principales componentes de la evaluación de las características de una muestra seminal. Se basa en la relación directa que hay entre proporción de espermatozoides anormales en el eyaculado, el tipo de defecto morfológico y su influencia sobre la fertilidad de los toros, por lo que siempre debe estar incluida en las pruebas de análisis espermático.
Es una evaluación que permite determinar la funcionalidad de los testículos, epidídimos y glándulas accesorias, dependiendo del tipo de anomalía presente en las células espermáticas como la cabeza, la parte intermedia o la cola. Sirve además para evaluar el número de espermatozoides vivos mediante el empleo de tinciones denominadas vitales, las cuales se basan en que las membranas de las células dañadas o muestras toman algunos colorantes.
Por medio de la tinción LIVE/DEAD® de Sperm Viabity Kid (Figura 22), el espermatozoide vivo, el cual tiene la membrana intacta, se tiñe de verde fluorescente y los espermatozoides muertos se tiñen de rojo-naranja fluorescente. (MELLISHO)
Figura 23. Espermatozoides teñidos con Ioduro de propidio y Diacetato de Carboxifluoresceina.
El espermatozoide con membrana plasmática intacta se observa verde brillante, el moribundo comienza a enrojecer y el lesionado es claramente rojo (1000 X) (HIDALGO)
A continuación se hará una revisión de las alteraciones más frecuentes en el semen del bovino.
 Si bien estos son los puntajes utilizados, actualmente se han establecido estandares mínimos para estos factores según la raza, así como para la clasificación del reproductor, el cual se fundamenta en los conocimientos y criterios del profesional para ubicar el reproductor en una de las siguientes categorías.
Si bien estos son los puntajes utilizados, actualmente se han establecido estandares mínimos para estos factores según la raza, así como para la clasificación del reproductor, el cual se fundamenta en los conocimientos y criterios del profesional para ubicar el reproductor en una de las siguientes categorías.
 Figura 25. El protocolo de dos pasos logra una concentración final de 20% de yema de huevo, 7% de glicerol, 500 microgramos de Tilosina, 250 microgramos de Gentamicina, 150 microgramos de Lincomicina y 300 microgramos de Espectomicina, por cada ml de semen diluido y congelado. Ejemplo de diluyente comercial disponible en el mercado para dilución en dos pasos es el Biladyl.
Figura 25. El protocolo de dos pasos logra una concentración final de 20% de yema de huevo, 7% de glicerol, 500 microgramos de Tilosina, 250 microgramos de Gentamicina, 150 microgramos de Lincomicina y 300 microgramos de Espectomicina, por cada ml de semen diluido y congelado. Ejemplo de diluyente comercial disponible en el mercado para dilución en dos pasos es el Biladyl.

Figura 28. Refrigeración a 4°C
Una vez efectuada la dilución se continúa con el marcado, llenado y sellado de las pajillas. Este proceso puede efectuarse a temperatura ambiente o después de enfriar la dilución del semen a 4°C, de manera manual o computarizada.
Actualmente se utilizan pajillas de 0.25 y 0.5 ml.
Después del llenado, las pajillas se sellan manualmente con polvo sellante a base de cloruro de polivinilo, selladores térmicos o selladores por ultrasonido, esferas metálicas o de vidrio, dependiendo del equipo utilizado.
Una vez empacado el semen se debe llevar a cabo una curva de enfriamiento lenta, la cual se inicia con la refrigeración de equilibrio a 4°C en un período de 4 horas.

Figura 30. Congelación.
Luego se procede a la congelación del semen mediante el sistema de vapor de nitrógeno líquido a -120 °C, colocando las gradillas con las pajillas a 4 cm sobre el nivel de nitrógeno, contenido en el recipiente para tal efecto. Enseguida las gradillas se introducen directamente en el nitrógeno líquido para ser conservadas a -180 °C -196°C.
Este proceso se efectúa de manera mecánica y computarizada en los Centros De Reproducción Asistida, lo cual lo hace más ágil, preciso y aseptico, dando una mayor seguridad y confiabilidad al usuario.
HIDALGO C. TAMARGO C.
MONFORTE C. ANALISIS DEL
SEMEN BOVINO. Publicaciones Serida
2005
El espermatozoide con membrana plasmática intacta se observa verde brillante, el moribundo comienza a enrojecer y el lesionado es claramente rojo (1000 X) (HIDALGO)
El espermatozoide, además de hiperactivar su motilidad para migrar en el tracto genital femenino y penetrar las envolturas del oocito, debe ser morfologicamente normal. Cualquier anomalía que interfiera con su transporte en el tracto genital de la hembra, impide su unión con el mismo y por consiguiente la fecundación, por lo que ante un alto porcentaje de anomalías en el eyaculado, disminuye la capacidad fecundante de éste. (MUIÑO)
Las anormalidades espermáticas se clasifican en primarias y secundarias. Se consideran anormalidades primarias, aquellas que ocurren o tienen su origen durante la espermiogénesis dentro del testículo, mientras que la anormalidades secundarias, se originan dentro del epididimo o en el laboratorio. (Figura 24)
Las norma ISO 9002 de calidad para centros de inseminación artificial a nivel mundial, establecida por el departamento de Medicina del Rodeo y la teriogenología de la Universidad de Saskatchewwan, Canadá, se contempla como anormalidades toleradas: cabezas 15-20%, acrosoma y cola hasta un 25% y un mínimo de 70% de espermatozoides normales. (BARTH)
A continuación se hará una revisión de las alteraciones más frecuentes en el semen del bovino.
Cabezas piriformes y angostas.- Presentan la zona posacrosomal más estrecha. Se encuentran estas anomalías junto con otras e indican defectos en la espermatogenesis. No obstante, se conocen casos en los que la mayoría de los espermatozoide eran de éste tipo y aún así, la fertilidad de los animales era normal.
Micro y Macrocefalia.- Aunque son comunes las cabezas demasiado grandes, generalmente se encuentran en una proporción muy pequeña en el eyaculado. Aparentemente estos defectos serían ocasionados por una distribución desigual de los cromosomas durante la meiosis y generalmente la mayoría de las células muere o son fagocitadas por las células de Sertoli, antes de llegar al estado de espermátida. Esta es la razón por la que no se encuentran en altos porcentajes en los frotis de semen.
Defectos en el acrosoma. En éste tipo de alteraciones nps encontramos con un acrosoma aumentado de tamaño. Con la tinción de Eosina-Nigrosina se observa que la mayoría de los espermatozoides tiene una región apical o una pequeña invaginación. Es bastante común en toros Charolais. Se ha demostrado que los espermatozoides afectados no pueden atravesar la zona pelúcida.
Cabezas sueltas. Se pueden hallar espermtozoides decapitados en un pequeño número en el semen normal. este defecto puede ser producido por envegecimiento o por una alteración en la implantación de la cola en la placa basal. Cuando se encuentra en mayor cantidad, están asociados con defectos en la termorregulación del testículo en animales gordos y en estos casos es producido, aparentemente, por un defecto en la espermiogénesis. En los casos de individuos demasiado gordos ésta alteración se encuentra asociada con otros defectos espermáticos como cabezas piriformes sueltas.
Las cabezas sueltas y muchos espermatozoides muertos se encuentran en animales con una acumulación de semen en la cola del epidídimo. Los espermatozoides envejecidos son eliminados normalmente de la cola del epidídimo a través de un movimiento peristáltico hacia la uretra. Se pueden observar en animales con mucho tiempo fuera de servicio. Igualmente se observan en frotis defectuosos al efectuar la extensión de la muestra.
Pieza Media Distal Plegada. Suele combinarse con pieza principal doblada. estos defectos se producen en la cola del epidídimo o en los últimos pasos de la espermatogenesis. Es ffrecuente en en toros estresados.
Colas abaxiales, accesorias y múltiples.- Estas anornalidades están usualmente asociadas entre si. Sin embargo, las colas abaxiales son las más comunes. Se han visto animales que producen hasta un 100% de colas abaxiales sin presentar reducción de la fertilidad. Es poco común pero aparentemente hereditaria. No se sabe si estos espermatozoides tienen reducida su capacidad de fertilizar el óvulo.
Pieza Principal Doblada.- Se observa que la pieza principal se encuentra doblada describiendo espiral inmediatamente detrás del anillo. Se presenta generalmente asociada con espermatozoides con piezas medias dobladas. En al mayoría de los casos, se observa también una gota citoplasmática distal en el centro del espiral. Este defecto aparentemente se origina en el epidídimo y no hay que confundirlo con el efecto producido por el shock hipotónico o estrés por frío de los espermatozoides.
Shock hipotónico.- Ete fenómeno ocurre cuando se exponen los espermatozoides por demasiado tiempo al efecto de la tinción Eosina-Nigrosina, aunque se produce también cuando los cubreobjetos están fríos, o cuando la muestra se contamina con orina. La patología se manifiesta con una curva pronunciada en la pieza principal y, en algunos casos más severos, puede llegar a afectar la pieza media. La diferencia con el defecto de pieza principal doblada es que en el shock hipotónico no se observa gota citoplasmática en el medio.
Si tenemos una alta incidencia de esta alteración y no estamos seguros de su causa, sería aconsejable realizar una segunda extensión.
Gota citoplasmática proximal.- Casi todos los espermatozoides que se encuentran en la cabeza del epidídimo, tienen una gota citoplasmática en ésta posición. Luego, a medida que van descendiendo hacia la cola del mismo, la cola se va desplazando distalmente, al menos en el 90% de los casos. Se puede observar una alta incidencia de gotas proximales, en animales jóvenes, quienes aún no han completado el período de la pubertad. En ejemplares adultos, las gotas proximales en el eyaculado son indicio de disturbios e la función epididimaria o testicular. Se pueden observar en toros con demasiada carga de servicios.
Se pueden observar aumentos agudos en el número de gotas proximales 7 a 10 días luego de una situación estresante en adultos, lo que indica que los espermatozoides se han afectado en su tránsito por el epidídimo. A pesar de que los espermatozoides aún si la gota proximal por sí misma afectada la capacidad de fertilización del espermatozoide.
Gota citoplasmática distal.- Entre el 65 y el 95% de los espematozoides almacenados en la cola del epidídimo tienen la gota citoplasmática en ésta posición. Este citoplasma residual es liberado cuando los espermatozoides se mezclan con los fluidos seminales en la eyaculación. existe un factor hemolítico en las vesículas seminales que induce la liberación de esta gota distal. Aparentemente este defecto no afecta la fertilidad, y por lo tanto, si el resto de los espermatozoides son normales el eyaculado en sí, se considera no patológico.
Células medusa.- Con éste nombre se designan a las células epiteliales ciliadas provenientes del conducto deferente, y se pueden encontrar en bajas cantidades en muestras de semen de animales con defectos graves en la función testicular. Generalmente la muestra de semen está diluída por lo que puede ser necesario centrifugarla para concentrar los espermatozoides. En algunos casos raros puede llegar a verse hasta un 5 - 10% de células medusas. La presencia de estas denota daño testicular grave.
Leucocitos.- Se asocian con procesos inflamatorios en la ampolla, glándulas accesorias o epidídimo. También puede deberse a infecciones de pene o prepucio. Los leucocitos que poseen la membrana celular intacta no se colorean con la eosina, por lo que se los ve como formaciones blancas algo irregulares, de un diámetro mayor a la cabeza de los espermatozoides. Aquellos con su membrana rota aparecen como cuerpos rosados en desintegración. En caso de sospecharse la presencia de estas células es conveniente realizar tinciones como Wright-Giemsa u otras específicas para tal fin. (PEZZONE)
CALIFICACION DE LA FERTILIDAD DEL REPRODUCTOR
Tabla 14. Calificación de la fertilidad.
 Si bien estos son los puntajes utilizados, actualmente se han establecido estandares mínimos para estos factores según la raza, así como para la clasificación del reproductor, el cual se fundamenta en los conocimientos y criterios del profesional para ubicar el reproductor en una de las siguientes categorías.
Si bien estos son los puntajes utilizados, actualmente se han establecido estandares mínimos para estos factores según la raza, así como para la clasificación del reproductor, el cual se fundamenta en los conocimientos y criterios del profesional para ubicar el reproductor en una de las siguientes categorías.
Satisfactorio.
Los toros deben ser aptos físicamente. Sobrepasar el mÍnimo recomendado de CE para esa raza y edad; deberían tener semen de buena motilidad con por lo menos un 70% de espermatozoides normales. No deberían haber más del 20% de espermatozoides con anormalidades nucleares y los espermatozoides con anormalidades del acrosoma o de la cola no exceder más del 25%, además no mostrar problemas genéticos, infecciosos u otros problemas o fallas que pueden comprometer el servicio o la fertilidad. (PAPARELA)
Calificación diferida
Es principalmente para toros de un año que son aptos físicamente pero producen semen de mala calidad, debido a la falta de madurez. Se espera una mala calidad de semen en toros puberes, sin embargo, se desconoce si la madurez sexual del toro producirá semen de calidad normal. Por lo tanto la determinación de la aptitud reproductiva deberá postergarse. (BARTH)
En relación con los toros adultos, esta categoría es apropiada para los toros de los que no se obtuvo un eyaculado satisfactorio y los toros con problemas tratables como vesiculitis. También sería apropiada para toros maduros que han sufrido una alteración en la espermatogenesis de los cuales se espera una recuperación. Por ejemplo, toros con lesiones leves del escroto pueden tener semen de mala calidad en el momento del examen, pero pueden recuperarse y reincorporarse al servicio. (PALACIOS)
Cuestionables
La categoría "cuestionable" sería apropiada en algunas situaciones como: toros con un CE apenas por debajo del mínimo recomendado, pero con calidad de semen satisfactoria; toros con anormalidades de conformación. El defecto de pezuñas en tirabuzón; toros con altos porcentajes de defectos compensatorios de semen o un poco menos del 70% de espermatozoides normales. (PALACIOS)
No satisfactorio
Toros con parámetros por debajo de lo aceptado y aquellos que muy probablemente no puedan mejorar su estado reproductivo. También toros que muestran fallas genéticas o problemas incorregibles, incluyendo enfermedades infecciosas, que comprometan el servicio o la fertilidad. En general se dice, que de estos toros se esperan malos resultados en el hato de vacas en época de servicio. Si es posible la recuperación normal de la fertilidad, esto debe consignarse en el espacio para comentarios. (BARTH)
Es interesante observar el trabajo de CARVAJAL y MOLINA en 2006 sobre evaluación de toros en tres regiones de Colombia, el cual da una idea de la situación reproductiva de los toros reproductores y la importancia de evaluarlos andrológicamente.
CALCULO DEL NUMERO DE DOSIS Y DILUCION DEL EYACULADO
Después de evaluar la calidad del semen y realizar el cálculo de la concentración espermática, es importante determinar la cantidad de espermatozoides con Motilidad Progresiva Morfológicamente Normales (MPMN) en el eyaculado. El número de MPMN será utilizado para calcular el número de dosis que pueden ser congeladas.
Tabla 17.- En el ejemplo siguiente se muestra la forma a seguir para calcular el número de dosis y dilución de una muestra de eyaculado.
La existencia de numerosas fuentes de variación de la fertilidad (toro,eyaculado, número de espermatozoides, hembra, etc) impone que el centro de inseminación artificial deba incluir en la dosis de semen congelado un número de espermatozoides bastante elevado. Cuando se utilizan 20 millones de espermatozoides/dosis, un porcentaje de ellos, con motilidad progresiva de 30 a 50% a la hora cero post-descongelación, permite disponer de entre 6 a 10 millones de células espermáticas con motilidad progresiva por dosis. El profesional puede solicitar o considerar cual es la concentración de espermatozoides (CABODEVILLA)
La CSS tiene aprobados dos protocolos para la dilución del semen bovino, que son:
- El Protocolo Estándar CSS, que es u método de dos pasos.
- El Protocolo Alternativo CSS, que es un método de un paso.
El protocolo estandar CSS es utilizado en los Estados Unidos y requiere de dos pasos. Los diluyentes más comunmente utilizados en el Protocolo Estandar CSS tienen como amortiguadores el Tris (Hidroximetil-aminometano) o el citrato de sodio, requieren de la yema de huevo para proteger las células espermáticas contra el choque térmico por frío y vienen presentados comercialmente con dos fracciones (A y B) y una mezcla de antibióticos. La Fracción B es similar a la Fracción A, excepto que contiene 14% de glicerol como crioprotector.
 Figura 25. El protocolo de dos pasos logra una concentración final de 20% de yema de huevo, 7% de glicerol, 500 microgramos de Tilosina, 250 microgramos de Gentamicina, 150 microgramos de Lincomicina y 300 microgramos de Espectomicina, por cada ml de semen diluido y congelado. Ejemplo de diluyente comercial disponible en el mercado para dilución en dos pasos es el Biladyl.
Figura 25. El protocolo de dos pasos logra una concentración final de 20% de yema de huevo, 7% de glicerol, 500 microgramos de Tilosina, 250 microgramos de Gentamicina, 150 microgramos de Lincomicina y 300 microgramos de Espectomicina, por cada ml de semen diluido y congelado. Ejemplo de diluyente comercial disponible en el mercado para dilución en dos pasos es el Biladyl.
Técnica De Dilución Del Semen

Figura 26.
Los antibióticos se adicionan cuidadosamente al semen puro en una proporción de 0.02 ml de la mezcla de antibióticos por cada ml de semen. Los antibióticos deben estar en contacto por 3 a 5 minutos con el semen puro, antes de proseguir con la dilución. En un matráz o tubo de ensayo de 50 ml, se diluyen el semen con antibióticos con un pequeño volumen de Fracción A precalentada en baño maría. dependiendo del número calculado de pajillas a procesar, el eyaculado debe luego diluirse con más Fracción A, hasta completar el 50% del volumen de diluyente total a utilizar. La Fracción A del diluyente debe tener la misma temperatura del semen al momento de mezclarse (28 - 32°C).
Enfríe el semen diluido lentamente durante un período mínimo de dos horas hasta llegar a 4°C. Para realizar este paso, el recipiente con el semen diluido debe dejarse enfriar a temperatura ambiente y luego se coloca en un refrigerador a 4°C. Nota: 300 ml de líquido con una temperatura de 30°C a 35°C disminuye su temperatura hasta 4°C en un período aproximado de 2 horas. El volumen de Fracción B se adiciona gradualmente al semen ya extendido con Fracción A durante un período de 30 minutos, hasta alcanzar una proporción 1:1. El volumen final de semen completamente diluido contendrá una concentración final de 7% de glicerol.

Figura 27 Triladyl
El semen ya completamente diluido debe tener un período de equilibrio a 4°C, por un mínimo de 4 horas. Este tiempo puede ser utilizado para llenar y sellar las pajillas y colocarlas sobre las gradillas de congelación y conteo e iniciar la curva de frío lenta.El protocolo alternativo es un método de un paso. Es el método más empleado en Europa. Está aprobado para ser utilizado con Tris (hidroximetil-aminometano) como amortiguador y requiere la adición de 20% de yema de huevo. El diluyente no está fraccionado y contiene 7% de Glicerol más los antibióticos.
El protocolo de un paso produce una concentración final de 100 microgramos de Tilosina, 500 microgramos de Gentamicina, 300 microgramos de Lincomicina y 600 microgramos de Espectomicina por cada ml de semen diluido y congelado. Un ejemplo de

Figura 26.
Los antibióticos se adicionan cuidadosamente al semen puro en una proporción de 0.02 ml de la mezcla de antibióticos por cada ml de semen. Los antibióticos deben estar en contacto por 3 a 5 minutos con el semen puro, antes de proseguir con la dilución. En un matráz o tubo de ensayo de 50 ml, se diluyen el semen con antibióticos con un pequeño volumen de Fracción A precalentada en baño maría. dependiendo del número calculado de pajillas a procesar, el eyaculado debe luego diluirse con más Fracción A, hasta completar el 50% del volumen de diluyente total a utilizar. La Fracción A del diluyente debe tener la misma temperatura del semen al momento de mezclarse (28 - 32°C).
Enfríe el semen diluido lentamente durante un período mínimo de dos horas hasta llegar a 4°C. Para realizar este paso, el recipiente con el semen diluido debe dejarse enfriar a temperatura ambiente y luego se coloca en un refrigerador a 4°C. Nota: 300 ml de líquido con una temperatura de 30°C a 35°C disminuye su temperatura hasta 4°C en un período aproximado de 2 horas. El volumen de Fracción B se adiciona gradualmente al semen ya extendido con Fracción A durante un período de 30 minutos, hasta alcanzar una proporción 1:1. El volumen final de semen completamente diluido contendrá una concentración final de 7% de glicerol.

Figura 27 Triladyl
El semen ya completamente diluido debe tener un período de equilibrio a 4°C, por un mínimo de 4 horas. Este tiempo puede ser utilizado para llenar y sellar las pajillas y colocarlas sobre las gradillas de congelación y conteo e iniciar la curva de frío lenta.El protocolo alternativo es un método de un paso. Es el método más empleado en Europa. Está aprobado para ser utilizado con Tris (hidroximetil-aminometano) como amortiguador y requiere la adición de 20% de yema de huevo. El diluyente no está fraccionado y contiene 7% de Glicerol más los antibióticos.
El protocolo de un paso produce una concentración final de 100 microgramos de Tilosina, 500 microgramos de Gentamicina, 300 microgramos de Lincomicina y 600 microgramos de Espectomicina por cada ml de semen diluido y congelado. Un ejemplo de
Técnica De Dilución De Semen
Iguale la temperatura del diluyente con la temperatura del semen, ubicando ambos componentes dentro de un Baño María a una temperatura de 28 a 32°C. Los antibióticos deben mantenerse a la misma temperatura.
Los antibióticos son adicionados cuidadosamente al semen puro, en una proporción de 0.02 ml de la mezcla de antibióticos por cada ml de semen. Estos deben permanecer en contacto con el semen puro por 3 a 5 minutos, antes de proseguir la dilución.
En un matráz o tubo de ensayo de 50 ml,el semen con antibióticos es diluido inicialmente con un pequeño volumen de diluyente, en forma lenta.
Dependiendo del número de pajillas a procesar, prosiga la dilución del semen hasta alcanzar el volumen total de dilución.
Enfríe lentamente el semen diluido, durante un período mínimo de 2 horas, hasta llegar a 4°C y continúe el proceso como en el protocolo estandar. (BARACALDO)
Iguale la temperatura del diluyente con la temperatura del semen, ubicando ambos componentes dentro de un Baño María a una temperatura de 28 a 32°C. Los antibióticos deben mantenerse a la misma temperatura.
Los antibióticos son adicionados cuidadosamente al semen puro, en una proporción de 0.02 ml de la mezcla de antibióticos por cada ml de semen. Estos deben permanecer en contacto con el semen puro por 3 a 5 minutos, antes de proseguir la dilución.
En un matráz o tubo de ensayo de 50 ml,el semen con antibióticos es diluido inicialmente con un pequeño volumen de diluyente, en forma lenta.
Dependiendo del número de pajillas a procesar, prosiga la dilución del semen hasta alcanzar el volumen total de dilución.
Enfríe lentamente el semen diluido, durante un período mínimo de 2 horas, hasta llegar a 4°C y continúe el proceso como en el protocolo estandar. (BARACALDO)
En la preparación de los diluyentes se puede utilizar un agitador magnético para asegurar su dilución y mezcla. Después del proceso de mezclado se puede o no filtrar el diluyente.

Figura 28. Refrigeración a 4°C
Una vez efectuada la dilución se continúa con el marcado, llenado y sellado de las pajillas. Este proceso puede efectuarse a temperatura ambiente o después de enfriar la dilución del semen a 4°C, de manera manual o computarizada.
Actualmente se utilizan pajillas de 0.25 y 0.5 ml.
Figura 29. Impresión, llenado y sellado.
Una vez empacado el semen se debe llevar a cabo una curva de enfriamiento lenta, la cual se inicia con la refrigeración de equilibrio a 4°C en un período de 4 horas.

Figura 30. Congelación.
Luego se procede a la congelación del semen mediante el sistema de vapor de nitrógeno líquido a -120 °C, colocando las gradillas con las pajillas a 4 cm sobre el nivel de nitrógeno, contenido en el recipiente para tal efecto. Enseguida las gradillas se introducen directamente en el nitrógeno líquido para ser conservadas a -180 °C -196°C.
Este proceso se efectúa de manera mecánica y computarizada en los Centros De Reproducción Asistida, lo cual lo hace más ágil, preciso y aseptico, dando una mayor seguridad y confiabilidad al usuario.
Figura 31. Transferencia al termo.
Después del proceso de congelación, las pajillas son transferidas a tanques de almacenamiento con nitrógeno líquido, utilizados para distribución y comercialización del semen congelado. Estos varían de tamaño y capacidad de acuerdo al número de animales a inseminar en la explotación.
Después del proceso de congelación, las pajillas son transferidas a tanques de almacenamiento con nitrógeno líquido, utilizados para distribución y comercialización del semen congelado. Estos varían de tamaño y capacidad de acuerdo al número de animales a inseminar en la explotación.
Una vez finalizado el proceso de congelación del semen, es importante evaluar cada lote de pajillas, tomando una muestra de varias de ellas al azar, para darles el visto bueno y calificarlas como aptas para venta e inseminación. Esta evaluación se lleva a cabo después de descongelarlas a 35°C en 30 segundos, hora 0 y 2 horas después. Se debe así mismo enviar una muestra para análisis microbiológico.
En la Tabla 18 se especifican los parámetros dentro de los cuales se considera que una pajilla de semen congelado-descongelado tiene una fertilidad aceptable.
En la Tabla 19 se especifican los parámetros dentro de los cuales se considera que una pajilla de semen congelado-descongelado tiene una fertilidad aceptable.
En un estudio realizado por CABODEVILA se muestran las principales causas de descarte de lotes de pajillas congeladas-descongelas que no alcanzan los valores recomendados de dos o más parámetros. (Gráfico 3)
En la Tabla 18 se especifican los parámetros dentro de los cuales se considera que una pajilla de semen congelado-descongelado tiene una fertilidad aceptable.
En la Tabla 19 se especifican los parámetros dentro de los cuales se considera que una pajilla de semen congelado-descongelado tiene una fertilidad aceptable.
En un estudio realizado por CABODEVILA se muestran las principales causas de descarte de lotes de pajillas congeladas-descongelas que no alcanzan los valores recomendados de dos o más parámetros. (Gráfico 3)
BIBLIOGRAFIA
ASOCEBU.
REVISTAS “EL CEBU” DINAMICA REGISTROS
2012
ASOCEBU.
REVISTA “EL CEBU”. SERVICIO
EFICIENTE AL SOCIO
ABRIL 15 2013
BARACALDO
M. BARTH A. BERTRAND W:- PASOS PARA
EL CONGELAMIENTO DE
SEMEN BOVINO: DESDE LA
COLECCION DEL SEMEN
HASTA EL ALMACENAMIENTO EN
EL TANQUE DE
NITROGENO LIQUIDO. 2007 www.ivis.org
BARTH, ALBERT, BO, GABRIEL,
TRIBULO, HUMBERTO. CURSO DE EVALUACIÓN DE TOROS Y CONTROL DE LA CALIDAD
SEMINAL: 16 AL 19 DE AGOSTO DEL 2000. 1 ED. CÓRDOBA (ARGENTINA). UNIVERSIDAD
CATÓLICA DE CÓRDOBA, 2000. 3-10, 55 P.
BARTH, A. D. BULL,
THUNDATHILL AND MAPLETOFT R. J. IMPORTANCIA DE LA CALIDAD SEMINAL Y EL USO DE
FIV PARA EL ESTUDIO DE EFECTOS ESPERMÁTICOS MEMORIAS V SIMPOSIO INTERNACIONAL
DE REPRODUCCIÓN ANIMAL - INRA PAG. 205-221, 2003.
BECALUBA
F.- NUEVAS TECNOLOGIAS PARA
EL MANEJO DE
LA DETECCION DE
CELO. www.produccion-animal.com.ar
BOGGIO J. EVALUACION DE
LA APTITUD REPODUCTIVA
POTENCIAL Y FUNCIONAL
DEL TORO. CAPACIDAD DE
SERVICIO
CABODEVILA J. CATENA M. EVALUACION DE SEMEN
CONGELADO-DESCONGELADO. 24/10/2012. ENGORMIX
CARVAJAL
P. MOLINA J. -
IMPORTANCIA DE LA
EVALUACION ANDROLOGIA DE
LOS TOROS 2006 http://www.slideshare.net/fincaproductiva/evaluacion-andrologica-de-los-toros-salle
ECHEVERRI J.- APRECIACION
DE LOS TESTICULOS
EN EL TORO. Revista
“El Cebú” 344 Mayo Junio 2005.
ECHEVERRI J.
HERRAMIENTAS DE UTILIDAD
EN LA PRACTICA
ANDROLOGICA BOVINA. Revista
“El Cebú” 380 Mayo-Junio 2011.
FRICKE P.- ENTENDIENDO
LA CLAVE PARA UNA REPRODUCCIÓN EXITOSA REPRODUCCIÓN Y SELECCION GENÉTICA NO 606
AUTOR: 2006
HERNANDEZ C.J. 2005. MANEJO
REPRODUCTIVO EN GANADO BOVINO LECHERO. UNAM.
HIDALGO C. TAMARGO C.
MONFORTE C. ANALISIS DEL
SEMEN BOVINO. Publicaciones Serida
2005
JIMENEZ C. TÉCNICAS DE
CONGELACIÓN Y SEXADO
DEL SEMEN BOVINO
Y SU IMPORTANCIA
EN REPRODUCCIÓN BOVINA.
MELLISHO
E. MANUAL DE LABORATORIO DE
REPRODUCCIÓN ANIMAL 2010 E. EVALUACIÓN DE CALIDAD SEMINAL
MORILLO M. SALAZAR S.
CASTILLO E. EVALUACIÓN DEL POTENCIAL
REPRODUCTIVO DEL MACHO BOVINO
INSTITUTO NACIONAL DE INVESTIGACIONES AGRÍCOLAS – INIA, 2012
PALACIOS CJ. TECNICAS PARA
LA EVALUACIÓN DE LA CAPACIDAD FECUNDANTE DE ESPERMATOZOIDES. MEMORIAS POSGRADO
DE REPRODUCCION BOVINA 2005 CGR COLOMBIA.
PAPARELLA, GIULIANO. SALUD
GENITAL - CALIDAD SEMINAL. V SEMINARIO INTERNACIONAL DE REPRODUCCIÓN BOVINA,
2001.
PALACIOS CJ. TECNICAS PARA
LA EVALUACIÓN DE LA CAPACIDAD FECUNDANTE DE ESPERMATOZOIDES. MEMORIAS POSGRADO
DE REPRODUCCION BOVINA 2005 CGR COLOMBIA.
PAPARELLA, GIULIANO. SALUD
GENITAL - CALIDAD SEMINAL. V SEMINARIO INTERNACIONAL DE REPRODUCCIÓN BOVINA,
2001.
SPROTT L.R. CARPENTER
B.B. EVALUACIÓN DE LA SALUD REPRODUCTIVA DE TOROS

















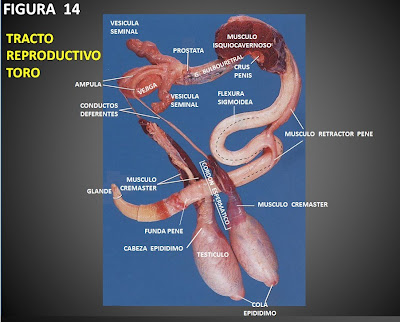





















Excelente información
ResponderEliminarGracias por su aporte